疫情之下,Takara助攻新冠抗体药物研发 |
| 目前新冠疫情呈现全球性大爆发,抗体药物和疫苗是两种有效地应对策略,各相关企业及研究机构纷纷致力于新冠药物的开发,以期能早日将特效药推向临床,战胜疾病。 |
| 近年来,由于单克隆抗体(mAb)的高特异性、高活性、良好的药代动力学特性以及成功的人源化改造策略,使得单克隆抗体(mAb)作为药物应用于癌症、神经退行性疾病以及其他病症的治疗取得了相当大的成功。 |
| 3月31日,清华大学、深圳市第三人民医院与腾盛博药宣布签署了关于新冠病毒全人源单克隆中和抗体的合作授权协议,力争半年内完成先导药物筛选及人体首剂用药的临床试验。此前,深圳市第三人民医院与清华大学医学院张林琦教授实验室合作,从8个病人的血浆中获得了206种针对新冠病毒S蛋白RBD的特异性抗体,那么如何快速从上百种抗体中筛选出适用于临床药物研发的抗体是一个巨大的挑战。 |
| 抗体药物筛选流程 |
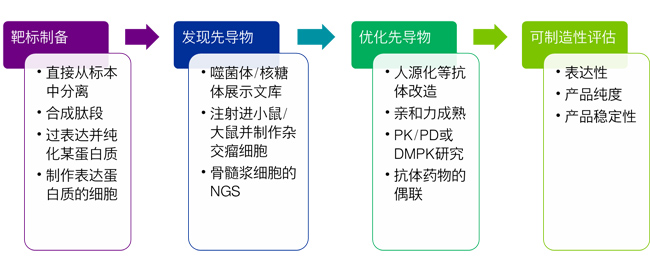 |
| 抗体药物筛选通常的工作流程包括从B细胞扩增分离可变区的cDNA,然后将这些区域克隆到表达载体或做相应的分析以便于下一步应用,在表达后进一步纯化、筛选表达的抗体并验证其与靶点的相互作用。 |
| Takara针对抗体药物筛选流程中涉及的大量的序列调取、克隆、表达以及纯化操作,可提供巧妙、高效、快速的方法,为进行新冠抗体药物研发的研究者提供新的思路和解决方案。 |
| 快速调取抗体可变区scFv序列 |
| 由于抗原抗体结合的特异性取决于抗体可变区的特异结构,所以分析可变区的序列是很多应用的第一步,这包括以噬菌体展示技术(用PCR技术从人免疫细胞中扩增出整套的抗体重链可变区(VH)和轻链可变区(VL)基因,克隆到噬菌体载体上并以融合蛋白质的形式表达在其外壳表面)为核心的大规模单抗筛选工作,以及对可变区结构进行稳定优化的抗体改造等工作。 |
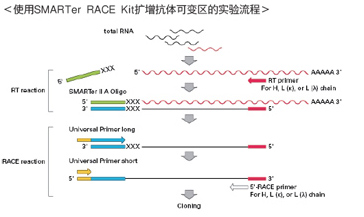
| 分析可变区时,设计一个通用引物来扩增所有抗体序列是非常困难的,因为重链和轻链5’端的天然可变性决定了序列同源性很低,一个有效的方法是在可变区下游的保守区设计简并引物,后续使用5’RACE(Rapid Amplification of cDNA Ends)的方法克隆这段目的区域,之后再进行测序。但普通的RACE方法常有扩增序列较短或操作步骤繁琐的缺点,因此错过了重要信息。 |
| Takara的SMARTer RACE cDNA合成技术可为抗体可变区的全长序列分析提供简单、灵敏、高效的解决方案。SMARTer RACE cDNA扩增试剂盒,结合了Clontech特别的SMARTer(5'末端RNA模板转换机制)技术,允许反转录酶达到转录本的5'末端,不需要adaptor连接等步骤,整个流程更快、更易操作,有效合成全长cDNA,大大减少了非特异性背景并提高了扩增效率。 |
 |
| BCR V(D)J可变区的快速分析 |
| B细胞抗原受体(B cell receptor, BCR)是B细胞表面负责特异性识别及结合抗原的分子,是科研人员研究机体获得性免疫的重点关注对象。有资料显示,每个个体的BCR多样性高达5*1013,赋予个体识别各种抗原、产生特异性抗体的巨大潜能。BCR多样性的重要意义不言而喻! |
| BCR多样性主要体现在BCR形成过程中V(D)J可变区域的重排,产生特定克隆型的BCR分子: |
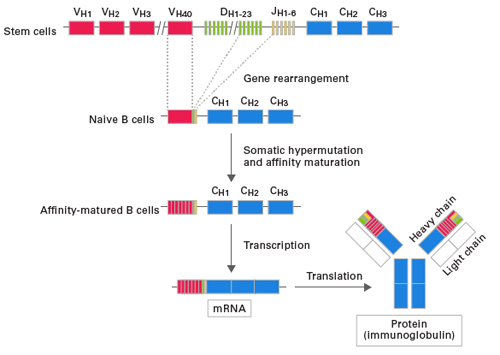 |
| BCR可变区序列重排后的成熟B细胞受到抗原刺激后,会经历高频突变的发生、FDC捕获抗原使表达高亲和力BCR的B细胞免于凋亡等过程,帮助特异性抗体的进一步成熟,有助于机体有效抵抗外来抗原的再次入侵。因此,无论是探索机体免疫应答机制还是抗体研发等应用,BCR可变区序列的分析至关重要! |
| NGS是BCR可变区序列分析的常见技术,而Takara的SMARTer Human BCR profiling kit是一种结合了5’RACE的BCR NGS建库技术,所建文库能完整分析BCR mRNA V(D)J的全长信息,添加的UMI能进一步提升测序结果的可靠性,搭配的Takara Bio Immune Profiler Software使得工作流程更完整更简便! |
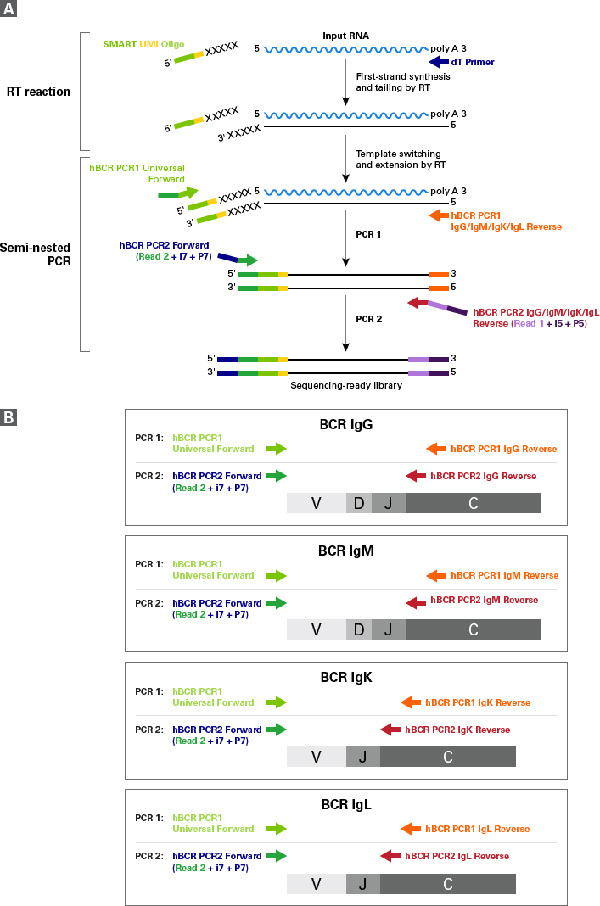 |
| SMARTer Human BCR profiling kit技术流程图 |
| 【产品信息】 |
 |
| 抗体序列的高通量快速克隆 |
| 传统酶切连接的克隆方法常存在缺陷:大片段连接效率低,核苷酸缺口,缺乏方向性以及载体/插入片段制备耗时。在研究某一个抗体时,这些缺陷造成的总体工作负荷延长可能还可以接受,但扩展至成百上千个克隆的高通量应用时问题就比较严重了,因为扩大化该工作流程就意味着扩大其潜在问题和增加了大量的故障排除工作。 |
| Takara的In-Fusion Cloning是一种无需连接酶、高效率的无缝克隆技术,基于载体和插入片段序列之间的同源重组原理,有助于快速、高效地将任意PCR片段克隆到任意目的载体中,背景低,克隆保证方向性,单片段克隆的成功率超过95%。In-Fusion克隆的快速和易用性以及结果的正确性,使系统可轻松应对高通量的工作流程。 |
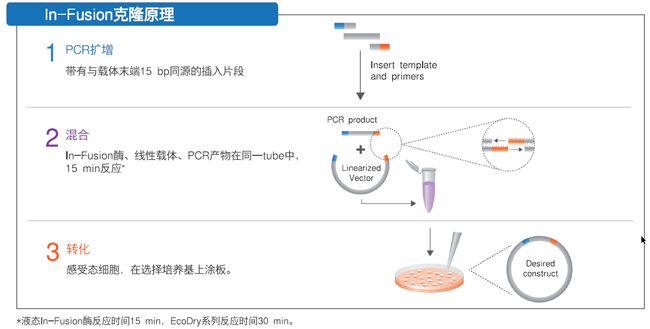 |
| 实验案例:使用In-Fusion对抗体可变区进行高通量克隆。 |
| 【数据提供】Jared L. Spidel, Morphotek, Inc.* |
| 【客户感言】 |
| “使用In-Fusion的阳性克隆率始终高于我们使用传统的酶切连接法,这使我们能够通过省略转化后涂板的步骤来简化我们的工艺流程并提高产量。由于大多数质粒都含有插入片段,我们可以将转化的细菌培养成库并直接进行小量制备。”——Jared L. Spidel,Morphotek,Inc. |
| 【实验方法】 |
| 通过RT-PCR以从B细胞分离的RNA为模板扩增可变区(V)的cDNA,其中引物在5'末端含有15 bp与信号序列或恒定区(C)同源的序列。使用In-Fusion HD克隆将V区cDNA插入片段克隆到其C区线性化载体中。转化后,每个转化产物取50 μl加入到含1 ml TB的96-well深孔板中摇动培养过夜。对培养物进行质粒提取,并进行DNA测序以确认所需插入片段的存在。为了确定In-Fusion克隆的效率,将甘油菌种划线并进行菌落PCR。 |
| 【实验流程示意图】 |
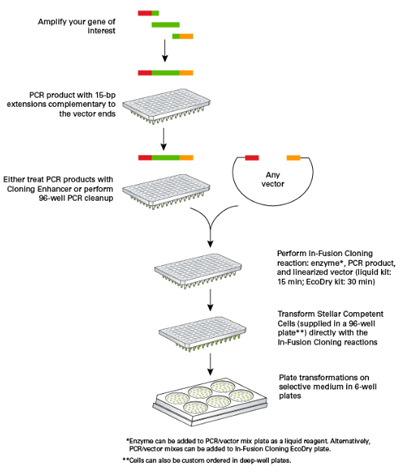 |
| 抗体的快速高通量纯化 |
| Takara的Capturem Protein A 和Protein G系列产品可以为抗体纯化提供快速高通量的解决方案。该系统基于Capturem™膜技术,膜上偶联了能够特异性地与IgG的Fc片段结合的protein A或protein G,可满足抗体小量快速纯化和96 well大规模快速筛选,兼具快速、易用、灵活和高产量(与同等体积树脂比较)等特点。 |
| 【实验操作流程】 |
| 使用Capturem Protein A会使工作流程更加连贯,减少抗体纯化和筛选的工作量,从而产生高质量的抗体。操作过程就如同提质粒般简单,每步操作之间进行1 min离心,小量纯化的总净化时间仅为5分钟,96 well高通量纯化可在15 min内完成。膜的柱床体积<3 μl,超过80%的抗体可以用低至100 μl的洗脱液实现高浓度洗脱。 |
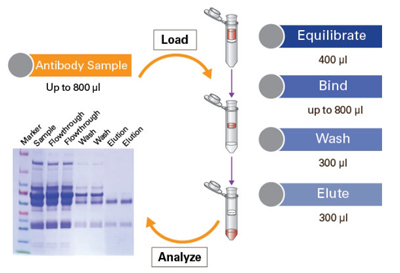 |
| 【Capturem柱上快速标记抗体工作流程】 |
| 使用Capturem技术,可直接对未纯化的起始材料进行快速的柱上偶联,从而在15分钟内标记抗体。 |
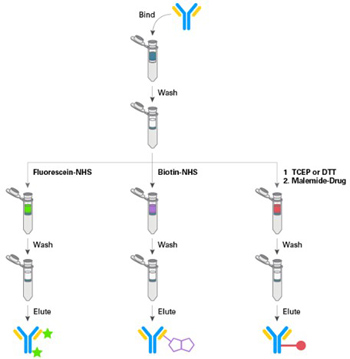 |
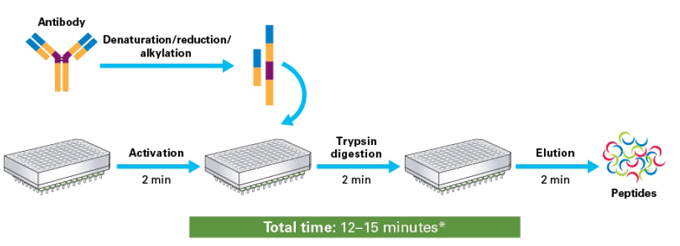
| 质谱检测前抗体的快速酶解消化 |
| 使用质谱(MS)对抗体药物进行准确的定性以及定量已经成为抗体药物研发过程中必不可少的环节,Takara的Capturem™ Trypsin和Pepsin可快速、有效地消化蛋白质样品,在室温下让MS工作流程更加连贯。该系列产品应用我们的新型Capturem膜技术,膜上固定有胰蛋白酶(Trypsin)或胃蛋白酶(Pepsin),仅需2-3分钟的时间即可高效消化蛋白质样品,能进行独立样品酶解,也可进行96-well的高通量酶解操作。不仅可以节省时间,还可以通过减少胰蛋白酶自溶来改善蛋白质组学分析中肽和蛋白质的鉴定。 |
| 【Capturem™ Trypsin酶解消化工作流程】 |
 |
页面更新:2020-06-01 09:13:38